有機化合物の安定同位体比が持つポテンシャル
はじめに:
自然界には,多種多様,ほぼ無限の種類の有機化合物が存在し,それぞれが非常に特徴的な機能・役割を持っています(... 持っているはずですが,よくわからないものが多い)。そして,有機化合物を構成する水素・炭素・窒素などの元素には安定同位体が存在し,その比率には,
- 地球上の物理化学・生化学反応の基質・経路・フラックスに対して定量的に変化する
- この基本原理が個々の反応スケールの研究から地球化学・地質学スケールの研究まで共通の一般則として広く適用できる
という2つの性質があります。従って,有機化合物の安定同位体比の研究には,適切な有機化合物(または,その一部の部位)の適切な元素の同位体比を,研究目的に合わせて「うまく」使うことができれば,我々の周りで起こる様々な現象の5W2H(who, what, why, when, where, how, how many)を,優れた精度で「定量的」に理解することができる,という可能性があり,またそれに挑戦する「おもしろさ」があります。この「おもしろさ」が,私たちの研究室の重要なモチベーションの1つであり,それを国内外の共同研究者や研究室の学生達と共有したいと考えています。
安定同位体に関する基礎知識
同位体分別:
安定同位体の存在量を変える要因には,主に,「静的同位体分別(equilibrium isotopic fractionation,平衡論的同位体分別)」 と,「動的同位体分別(kinetic isotopic factionation,速度論的同位体分別)」 の2つがあります。
静的同位体分別は,
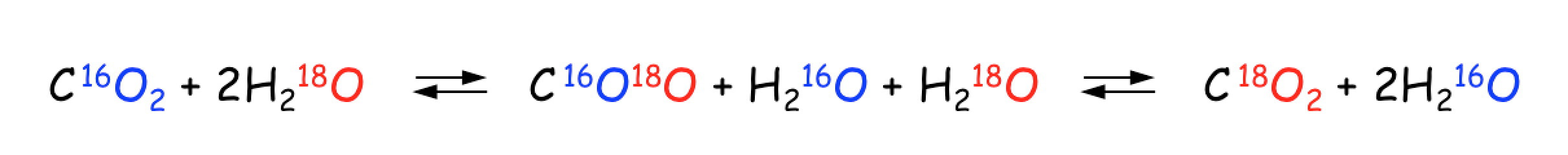
のように,単一もしくは複数の化学種の中で,同位体存在の交換が生じ,異なる同位体比を持つ化学種が存在することを示します。これは「同位体平衡反応」とよばれます。
(注意:同じ「平衡」という言葉を使うため,化学平衡反応で生じる同位体分別のことを,「平衡論的同位体分別」と呼ぶ研究者がいますが,これは間違えです。)
平衡論的同位体分別の特徴は,同位体分別係数(α)が,温度(T)の関数になることです。
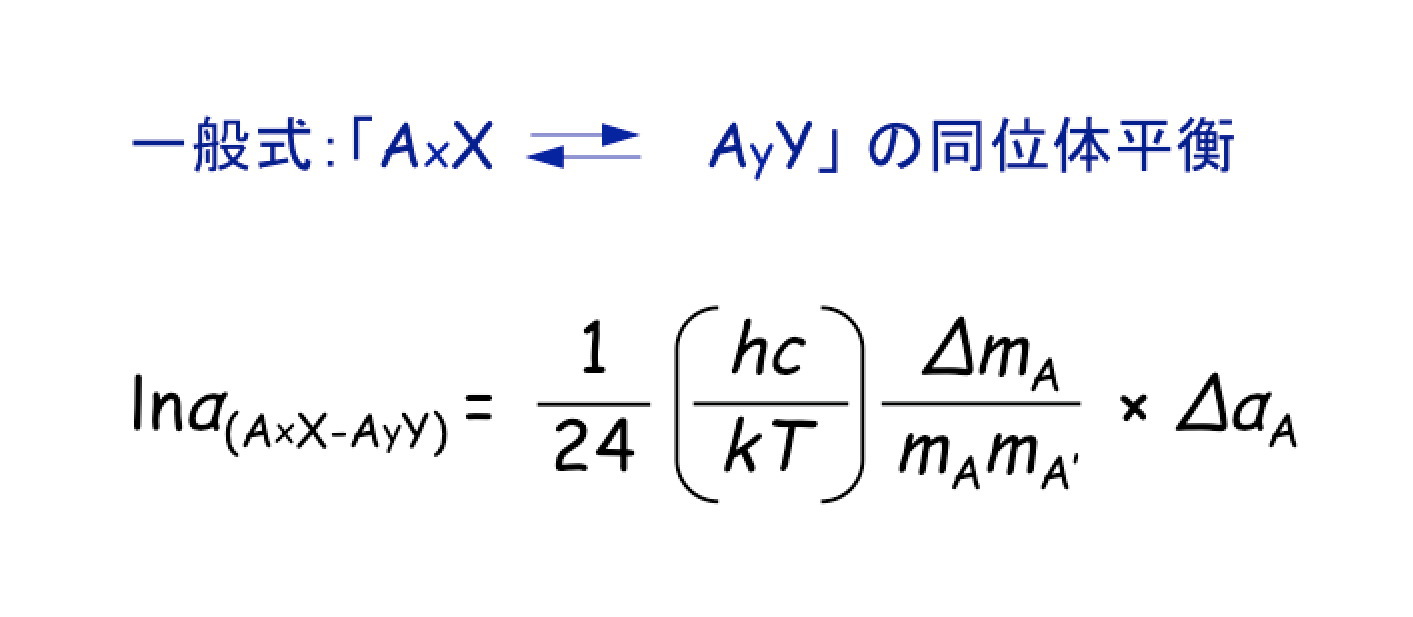
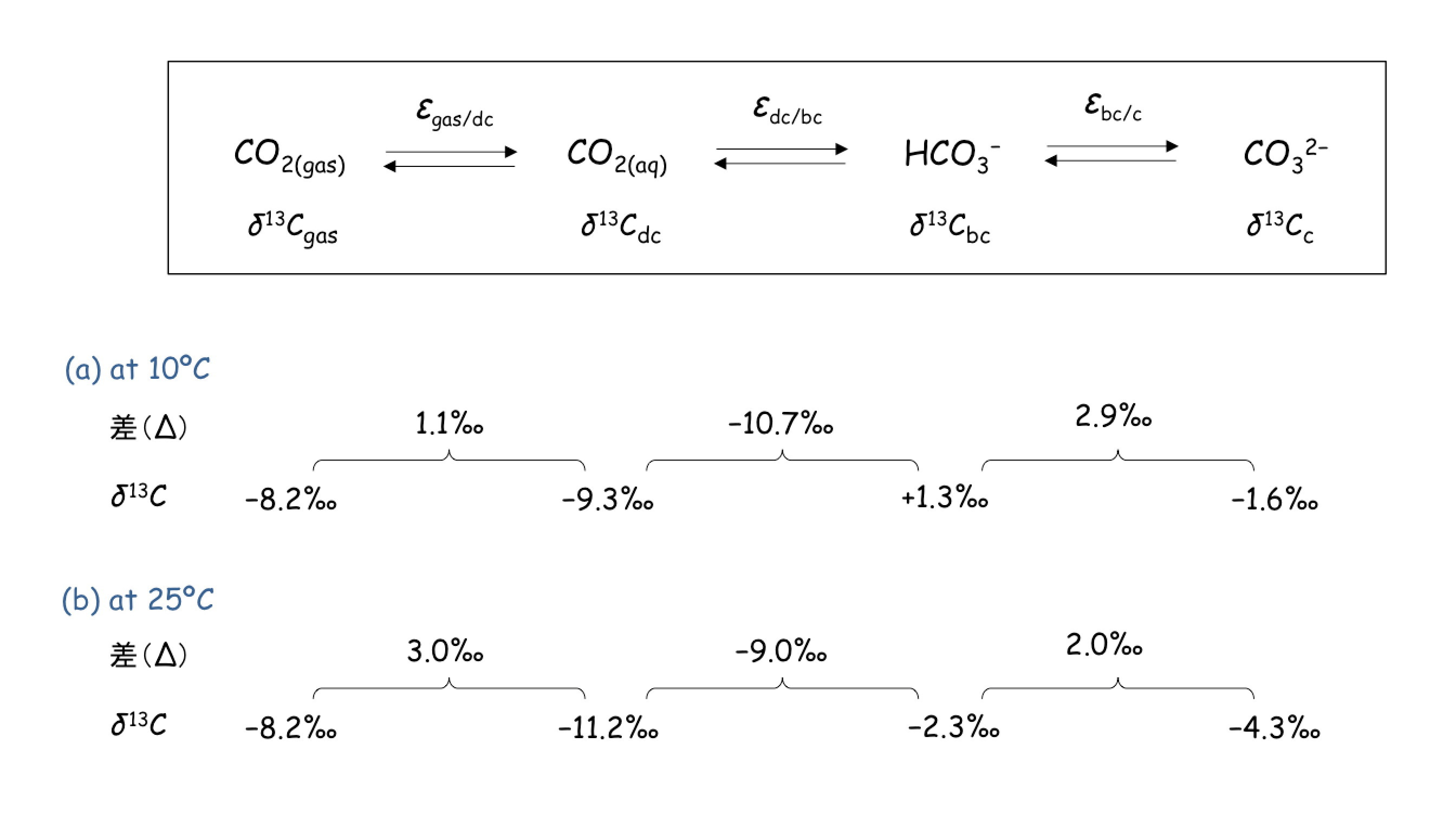
実際に,二酸化炭素の様々な化学種間の同位体平衡に関する,同位体比(δ)と同位体分別(ε)は,以下のように温度により変化します。
静的同位体分別は,
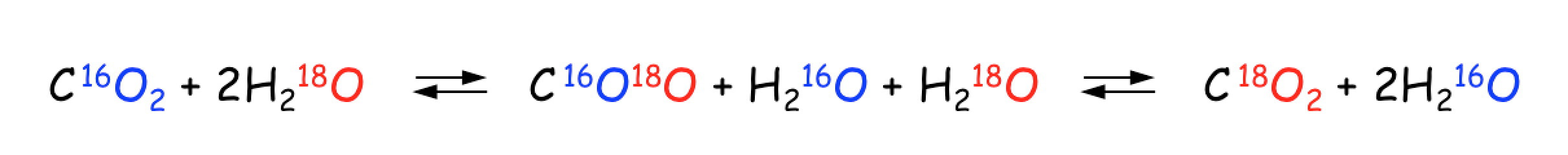
のように,単一もしくは複数の化学種の中で,同位体存在の交換が生じ,異なる同位体比を持つ化学種が存在することを示します。これは「同位体平衡反応」とよばれます。
(注意:同じ「平衡」という言葉を使うため,化学平衡反応で生じる同位体分別のことを,「平衡論的同位体分別」と呼ぶ研究者がいますが,これは間違えです。)
平衡論的同位体分別の特徴は,同位体分別係数(α)が,温度(T)の関数になることです。

実際に,二酸化炭素の様々な化学種間の同位体平衡に関する,同位体比(δ)と同位体分別(ε)は,以下のように温度により変化します。

動的同位体分別は,
右図に示すように,一般的な化学・生化学反応において,生成物は原料に比べて軽い同位体の比率が多くなります。これは,運動エネルギー(厳密には,振動エネルギー)が「質量依存」のため,軽い同位体のほうが,重い同位体よりも,反応に必要なエネルギーが小さいため,と説明することができます。
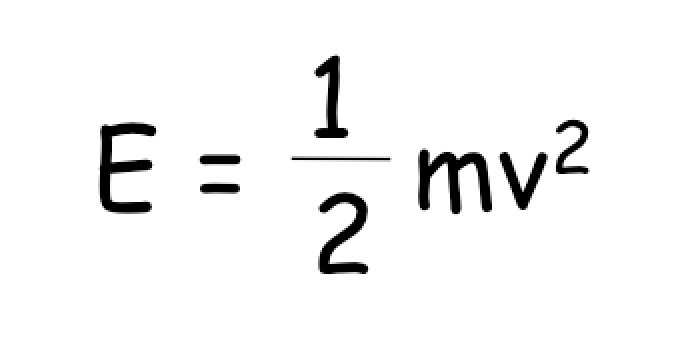
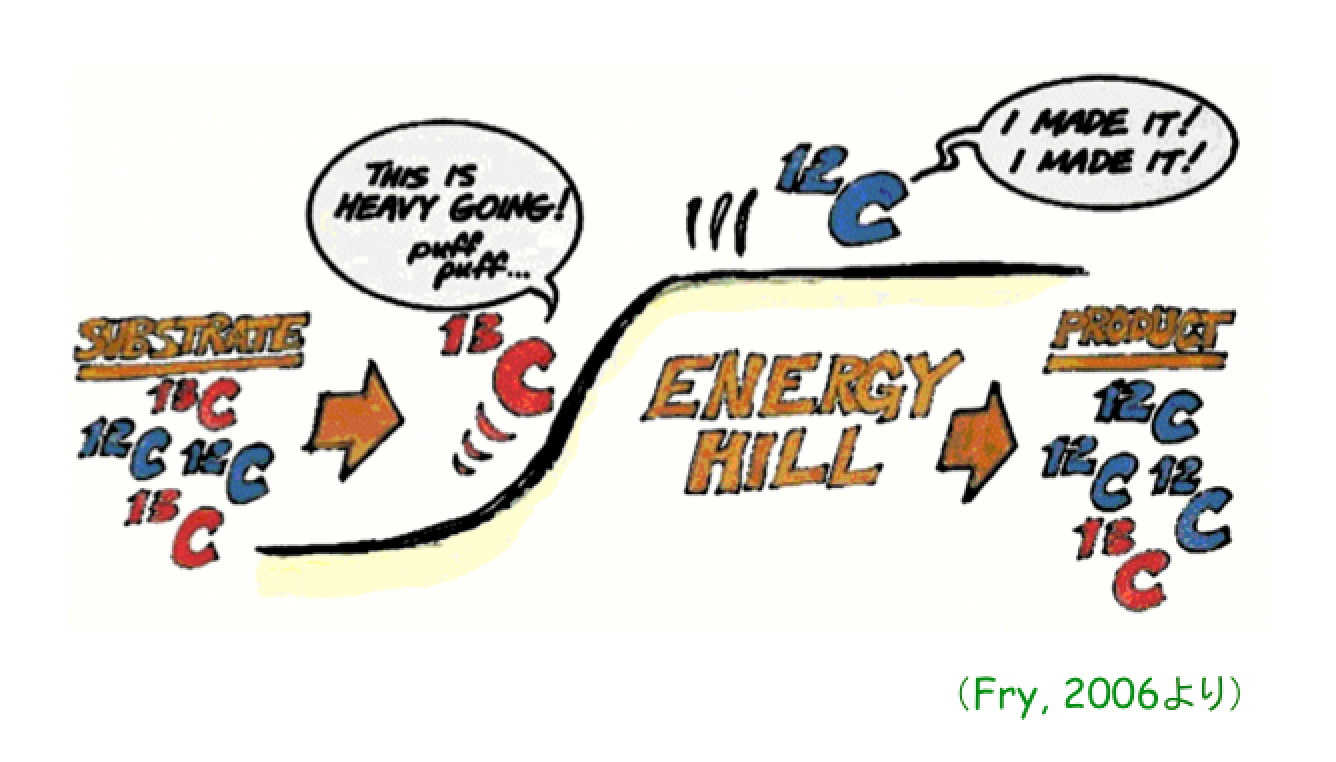
動的同位体分別の特徴は,同位体分別係数(α)が,基質の残存率(F)の関数になることです。
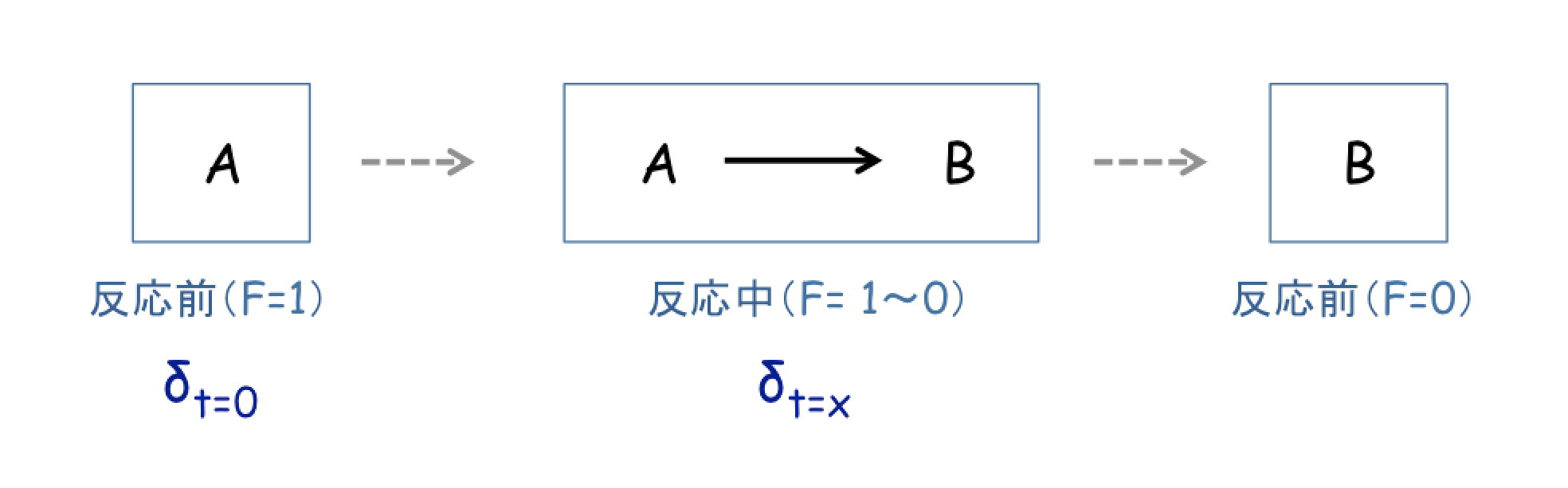
の反応において,すべての基質が反応した場合(これを,「定量的な反応」という*1)には,反応前の基質の同位体比(δt=0)と,反応後の生成物の同位体比は,等しくなります。
しかし,基質の一部が反応し,一部が反応せずに残される場合(これを「非定量的な反応」という*1)には,
反応前の基質の同位体比(δt=0)と,反応途中の基質(または,反応完了後に反応せずに残った基質)の同位体比(δt=x)は,以下の「レイリー分別モデル」で示すことができます。
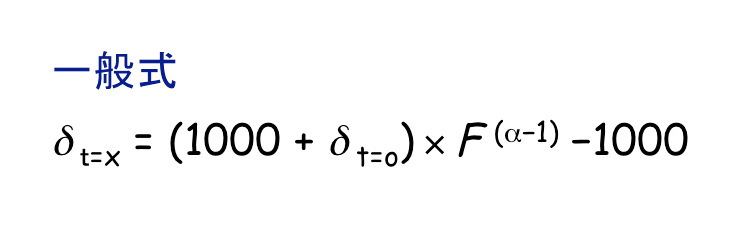
そして,変形式(1)で示すように,y軸に ln[(1000 + δt=x)/(1000 + δt=0)],x軸にlnF,傾き(α−1)を持つ原点を通る一次直線(y = ax)で表記できます。
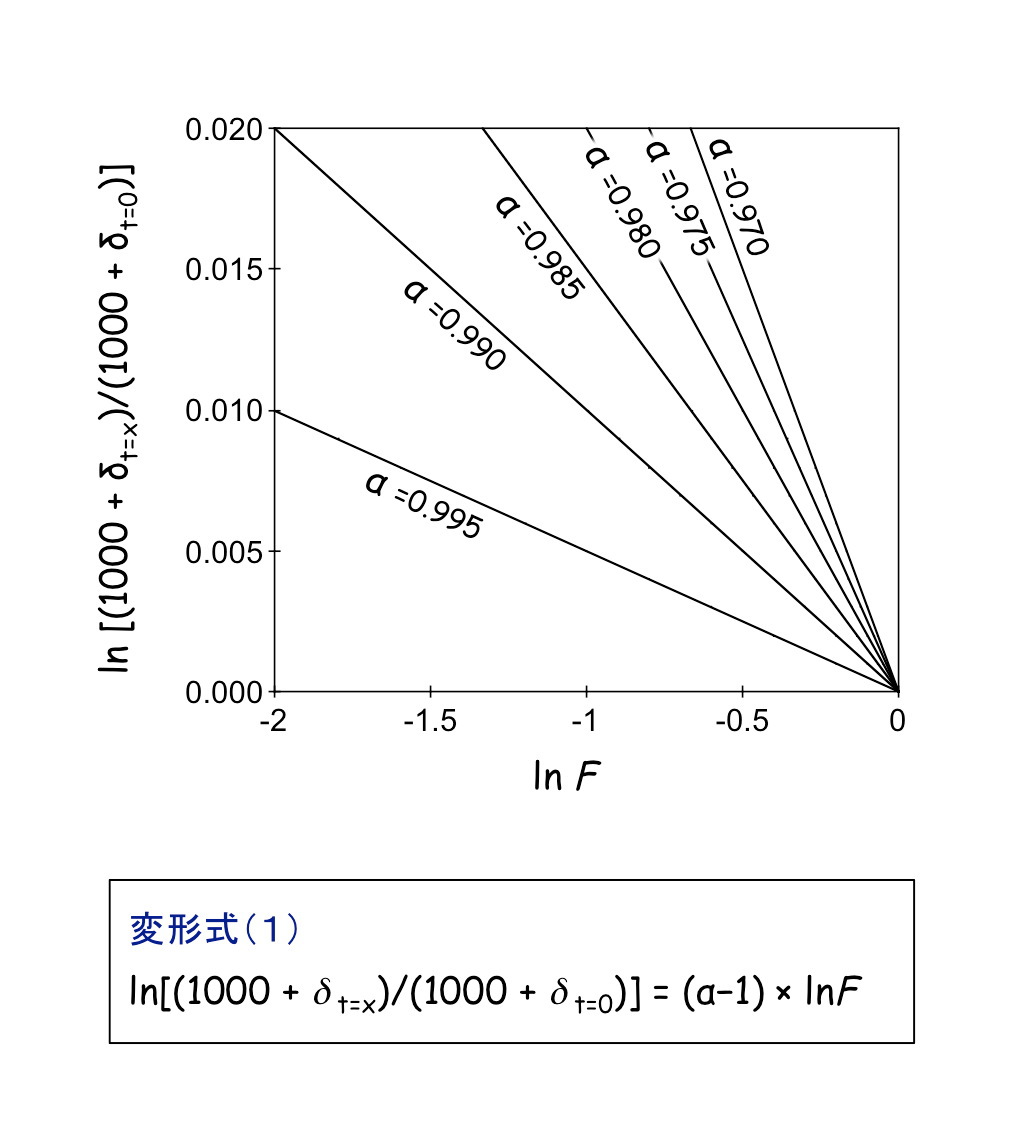
また,変形式(2)で示すように,反応前後での同位体比の変化:(Δ = δt=x − δt=0)は,F の(α−1)乗の関数として,下図の様な関係が得られます。
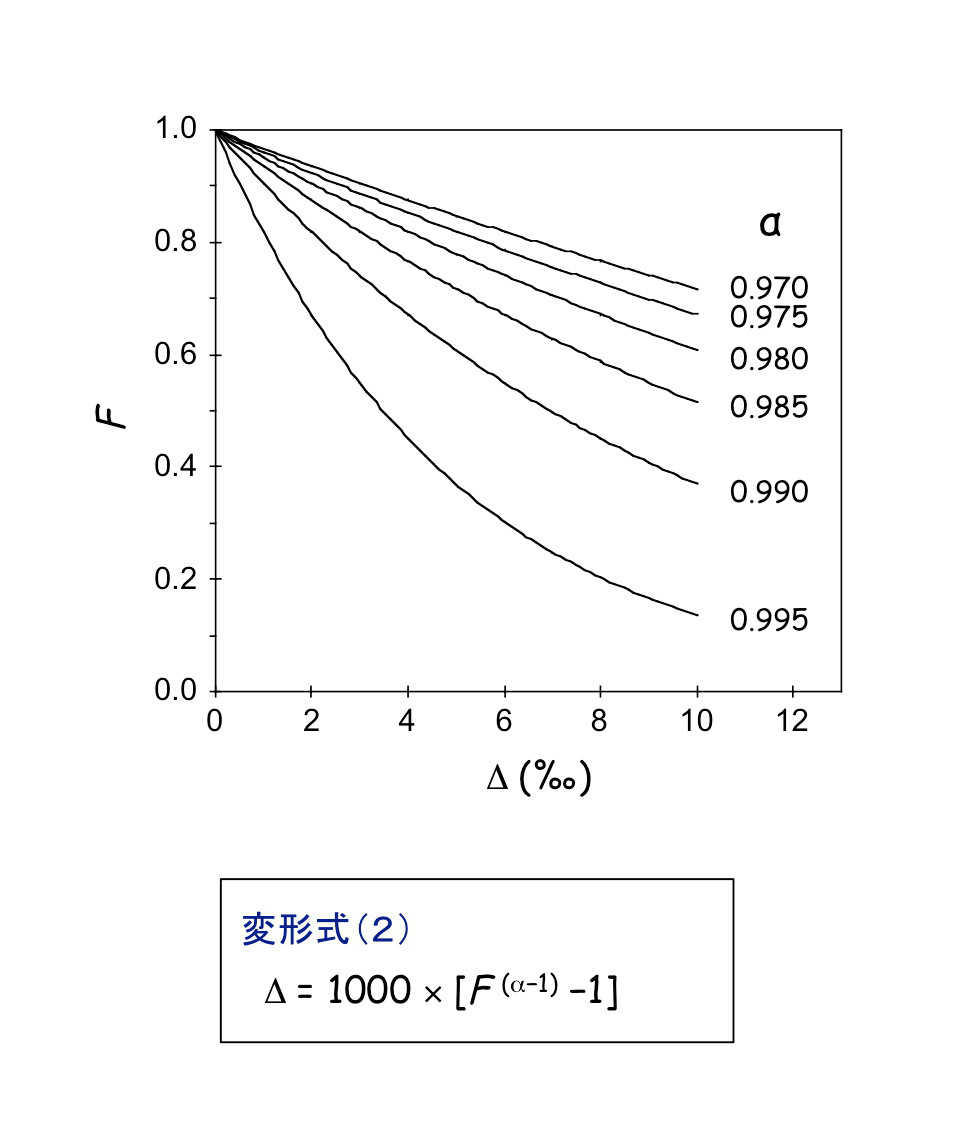
(*1)定量的・非定量的反応
塩酸と水酸化ナトリウムとの間の中和反応は,一般的に以下の式で示されます。
HCl + NaOH → NaCl + H2O
この反応で,仮に生成物(NaCl)が90%生成する場合,この中和反応の「反応率」は,90%であると記されます。
一方で,「定量的,非定量的」反応というのは,この「反応率」とは全く異なる概念で,基質が完全に反応したか,残されているのかを意味します。例えば,
10×HCl + 1×NaOH → 9×HCl + 1×NaCl + 1×H2O
の反応のように,反応する2つの基質が異なるモル量で存在した場合,仮に「反応率=100%」であっても,
・多量に存在する1つの基質は,完全に反応しない(10%のみが反応する)
・少量に存在するもう1つの基質は,完全に反応する(100%が完全に反応する)
ということが起こります。このような場合に,前者(HCl)は「非定量的」に反応し,後者(NaOH)は「定量的」に反応したと記されます。
このように,動的同位体分別は,基質の残存率(F)の関数になりますので,「非定量的」な生化学反応で観測されます。
[Major Contents]
Welcome English / 日本語
People/メンバーの紹介
Research subjects/研究の概要
Seminar/研究室ゼミ
Prospective Students/学生募集
Fee for Analysis/依頼分析
スポンサー/Sponsorship
[Others]
安定同位体比を用いた研究の基礎知識
海水魚とサンゴの飼育: 概要 と 注意点
水槽の説明と自作 と ギャラリー
コラム:研究者を志す皆さんへ
研究室の写真: Instagram と 写真ギャラリー


